바이러스 조작기술이 맹안질환 유전자치료 향상시켜
시력을 회복할 수 있는 효과적 치료법 고안
유전성의 망막변성은 전 세계 인구중 1/3000 명으로 발병하여 주로 망막의 가장 윗층세포에 주로 변이를 보인다. 여기에는 광수용세포(light detecting neuron, 척추동물의 망막에 있는 광 감지 뉴런) 또는 망막색소세포[(retinal pigment epithelium), 광수용체의 외부에 위치하며 광수용체를 지지하는 세포]가 있고, 이 두 세포 즉 망막의 바깥쪽이 안과 유전자 치료의 주 표적이다. 이 세포들에 변이가 일어난 세포의 유전자를 대체한 정상 유전자를 넣어주는 과정을 transduction[형질도입, 여기에서는 AAV에 넣어준 정상유전자가 병적세포의 염색체내로 들어가서 정상기능을 나타내는 과정]이라고 한다.
유전성 망막변성 질환은 AAV(adeno-associated virus) 유전자 치료가 임상적으로 가능성이 높다. 이 질환은 망막의 광수용체 세포나 망막의 색소상피의 mRNA 전사에 병적 변이로 소포사와 구조적 변화가 붕괴되는 질환이다. 기존의 유전자치료는 손상을 일으키는 망막하 주사를 사용하고 망막의 일부분에 유전자를 도입하기 때문에 제한적이었다. 그리고 망막의 구조가 정상인 경우인 매우 드문 유전질환에만 적용하였다. 보다 광범위하게 활용할 유전자 운반 방법의 필요성에 부응하기 위하여, 주입후 외부 망막까지 유전자 삽입체를 운반할 수 있는 AAV를 조작하여 생체내 발전을 수행하였다(큰 그림).
미국 유씨버클리의 연구자들이 유전자를 안구세포에 삽입하는 보다 쉽고 효과적인 방법을 개발함에 따라 노인성 변성질환인 황반변성이나 망막색소증 같은 유전질환으로 인한 맹질환자의 시력을 회복할 수 있는 유전자치료를 더욱 확장시켰다. 기존의 치료와 달리, 새로운 방법은 빠르고, 외과적으로 비침습적이며, 전체 망막에 걸쳐있는 접근이 어려운 세포들에 새로운 유전자를 운반해준다.
지난 6년간 몇몇 연구팀들이 희귀한 유전성 안질환자의 결함유전자를 가진눈의 망막에 정상유전자가 포함된 바이러스를 직접 주사함으로써 성공적으로 치료하였다. 침습적 과정에도 불구하고 정상유전자를 가진 바이러스가 수리가 필요한 망막의 전 세포에 도달할 수 없었다. 화학 및 생분자공학과의 교수이며 버클리 줄기세포센터의 소장인 데이비드 샤퍼 교수는 망막을 통해 바늘을 찔러넣어 망막뒤로 조작한 바이러스를 주입하는 것은 위험한 외과방법이다. 그러나 의사들은 다른 선택이 없었다. 왜냐하면 유전자 전달 바이러스가 눈뒤로 들어가서 광수용체 즉 치료유전자가 필요한 광민감세포에 도달시키는 방법이 없었기 때문이다.
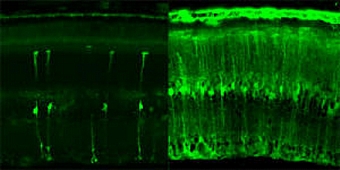 |
| ▲ 망막세포에 녹색형광을 표지한 바이러스가 들어간 사진. (왼쪽은 기존의 바이러스 전달방법, 오른쪽은 이번에 개발한 유전자치료용 바이러스 망막의 가장 바깥쪽에 있는 중요한 광수용체를 표적으로 녹색형광이 이동하였다.유씨버클리 제공) |
샤퍼와 동료들은 임상의들과 함께 이 유전자 전달 기술로 가장 혜택을 볼 수 있는 환자들을 확인하기 위하여 협력하고 있으며, 몇 가지 전임상 개발 후에 곧 임상시험에 들어가기를 희망하고 있다. 샤퍼와 분자세포생물학의 교수인 존 플래너리와 신경과학연구소, 안연구소 등의 공동연구자들의 연구 결과는 사이언스 이행성 의학 학술지(Science Translational Medicine) 6월 12일자에 게제하였다. 의학신문의 독자들 대부분은 이행성 의학(translational medicine)이란 단어가 생소하여 무슨 뜻인지 의아해 할 수 있다. 이 단어가 의학계에 도입된 것은 2005년 미국 국립보건원의 소장인 엘리아 저후니 박사가 뉴잉글랜드 의학회지(N Engl J Med 2005; 353:1621-1623)에 발표한 translational and clinical science- Time for a new vision 가 발표된 시기부터이다. 각기 다른 사람에게 다른 방법을 의미하지만, 모든 사람에게 중요하게 보이는 연구를 이행성연구라고 한다. 이행성 연구, 이행성 의학에 대한 설명이 많지만, 시카고대학의 이행성 의학 연구소의 홈피에 나와있는 단계를 보면, T1 (translational phase 1)은 과거의 임상치료에서 난치, 불치라고 불렀던 질환들을 치료하기 위한 새로운 기술이나, 치료방법을 개발하는 연구가 실험실에서 임상, 지역사회로 이행하는 단계이며, 연구자들은 대개 전임상연구와 임상시험의 1기와 2기를 시행한다. T2는 연구발견을 3, 4 임상시험, 관찰연구와 답사연구 등이 해당된다. T3는 특정한 치료와 기술 등 이행성 연구를 실지 세계의 상황에 정착시키는 진료중심단계이다. T4는 정책에 중점을 둔다. T1-T3가 성공적인 경우 다음단계는 국가 수준에서 특정 질환의 치료 또는 방침으로 임상의와 환자에게 가장 최고의 방법을 확립하는 단계이다.
유전자치료를 위한 양성 바이러스의 이용
세 그룹의 다른 연구자들이 희귀질환인 레버의 선천성 흑암시[(Leber's congenital amaurosis), 뇌의 병변으로 인하여 볼 수 없는 질환, 눈에 외과적 상처가 없다. 청소년기에 시야가 완전히 소실된다.] 환자 12명 이상에서 일부 시력을 성공적으로 회복하였다. 유전자를 adeno associated virus(AAV)에 삽입한후 망막에 직접 주사하여 성공하였다. 광수용체 세포가 바이러스를 받게되면 기능성 유전자가 중요한 단백질을 만들게 되어 광수용체를 회복시키고 시력을 회복하는 방법이다.
불행히도 이 기술은 주사 바늘이 망막박리를 유발하여 상태를 더 악화시킬 수 있어서 대부분의 다른 맹질환에 응용할 수 없었다. 더욱이 눈에서 사용하는 표준 AAV와 다른 형태의 유전자 치료법은 조직을 뚫고 광수용체와 다른 세포 즉 망막색포상피 등에 도달할 수 없었다. 망막은 20 나노미터의 아데노바이러스에 비하여 10만 배 더 두껍다.
 | ▶ 새로 개발한 AAV를 형질변환 마우스의 눈에 초자체에 주사하고 1주일째 안구 적출후 망막을 분리하여 FACS로 확인하고 PCR로 클로닝과 리팩케이지를 확인하는 과정. RGC(망막 신경절 세포), RFE( 망막 색소상피). 모식도에서 색갈이 다른 AAV가 몇 차례의 과정을 거치면서 망막세포에 들어가는 것을 확인할 수 있다. |
수년 전 샤퍼는 AAV를 특정세포에 유전자를 전달하기 위하여, 조직내 즉 눈과 간에 침투시킬 방법을 모색하였다. 지금까지 1억개의 AAV를 생산하여 이중 망막에 효과적으로 침투하는 5개를 선택하였다. 유전성 맹안인 X 연관 망막층간분리[망막이 스위스 치즈 모양으로 생기고 남아에서 발병한다], 레버 선천성 흑암시의 마우스모델을 치료하기 위한 유전자치료에 사용하였다. 초자액에 주입하면 AAV가 교정용 유전자를 망박의 전체 부위에 운반하여 망막세포를 거의 정상으로 회복시켰다.
이 바이러스를 정상 원숭이의 눈에 주사하면 바이러스가 망막의 전체에 고르지 않게 세포에 침투하였다. 그러나 완와부의 매우 중요한 미세-시야 부분은 거의 완전히 들어갔다. 그러나 이번의 바이러스는 완와 세포를 결코 침투하지 못하였다. 샤퍼는 이 바이러스가 기능을 못하는 유전자의 기능을 회복시키는 유전자를 넣어줄 뿐 아니라 황반 변성처럼 망막세포를 활발하게 죽이는 과정을 억제시키거나 유전자를 결손시킬 수 있다. 샤퍼는 14년전 처음 이 연구소에 왔을 때 인간의 건강에 직접적 영향을 주는 문제를 해결하기 위한 아이디어나 목표를 갖고 있었다. 이제 우리는 거기에 도달하였다.
사이언스데일리 (2013.06.13)

