전년比 15% 성장…종근당·대웅·대원, 국내사 임상 최다 ‘빅3’ 등극
[의학신문·일간보사=김민지 기자] 지난해 국내 임상 시험 건수가 사상 처음으로 1000건을 돌파하며 신약 강국을 향한 제약사들의 본격적인 도전이 시작됐다.

일간보사의학신문이 식품의약품안전처를 통해 확인한 결과, 2020년 식약처로부터 임상시험을 승인(모집 포함) 받은 기관은 총 280곳으로 1121건의 승인(피험자모집 중이거나 완료된 200건 포함)을 받은 것으로 집계됐다. 이는 전년(974건) 대비 15% 늘어난 수치로 제약사가 임상 연구개발에 집중했다는 의미다.
임상시험 승인을 받은 기관들 중 최다 허가를 받은 곳은 연구개발 수탁전문기업(CRO)인 한국아이큐비아로 40건을 차지했다. 전통 제약사로는 종근당이 35건을 차지해 수위를 지켰다.
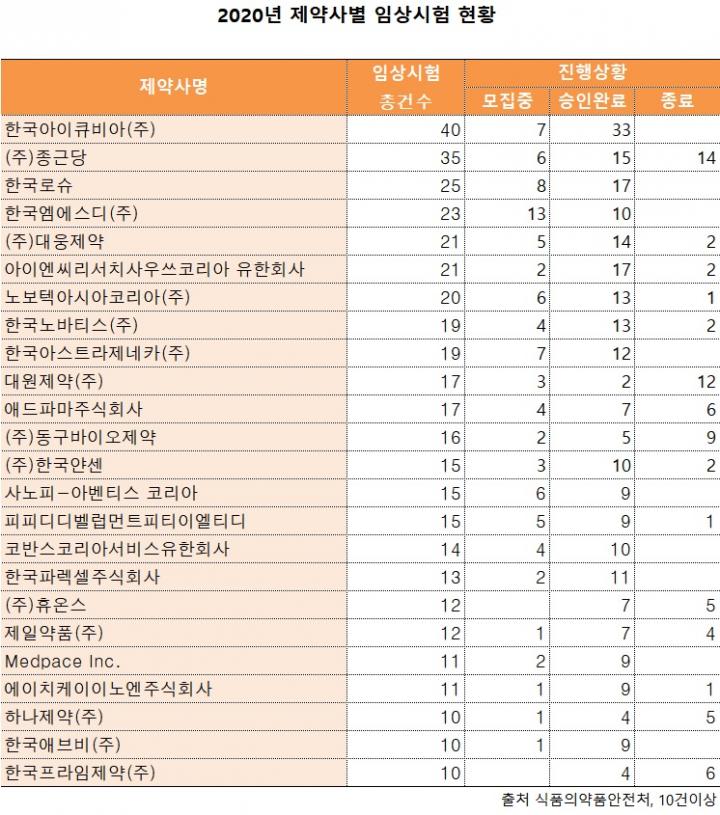
종근당에 이어 한국로슈(25건), 한국엠에스디(23건), 대웅제약(21건), INC리서치사우쓰코리아(21건), 노보텍아시아코리아(20건), 한국노바티스(19건), 한국아스트라제네카(19건), 대원제약(17건), 애드파마주식회사(17건), 동구바이오제약(16건) 순으로 제약사들이 임상 시험 계획을 승인 받았다.
종근당은 국내에서 임상3상 1건과 2상 1건, 33건의 임상1상에 대한 시험을 승인 받았다. 이들 중 임상을 진행하기 위해 모집 중인 건수는 6건, 임상 승인 계획이 완료된 건은 15건, 종료된 건이 14건으로 확인됐다.
임상 3상을 진입하게 된 제품은 점안제 CKD-352(성분명 다쿠아포솔나트륨)로 안구건조증 환자를 대상으로 유효성 및 안전성을 평가하고 있다. 특히 코로나19 치료제로 주목받고 있는 CKD-314은 나파모스타트메실산염(Nafamostat mesilate)을 주성분으로 임상 2상을 진행 중이다.
최근 종근당은 러시아 임상2상 결과, 나파모스타트가 주성분인 ‘나파벨탄’의 코로나19 치료 효과를 확인했다고 밝혔다. 회사는 이번 결과를 바탕으로 이달 내 식약처에 임상3상 및 조건부 허가를 신청할 예정이다.
회사는 이외에도 ‘리퀴시아정 5mg’과 한국비엠에스제약 ‘엘리퀴스 5mg’의 생물학적 동등성 평가, ‘텔미트렌에스정 80/20mg’과 유한양행 ‘듀오엘정’의 생물학적 동등성 평가 등 임상 1상등을 진행 중이다.
대웅제약은 임상3상 8건과 2/3상 1건, 임상1상 12건의 시험 계획을 승인 받았다. 특히 임상 3상 중에서는 ‘DWP16001’이 3건으로 확인됐다. DWP16001은 제2형 당뇨병 치료제로 ‘신속심사대상 의약품’으로 지정된 바 있다. 현재 DWP16001은 단독요법, 메트포르민(metformin)과의 병합요법, 메트포르민과 제미글립틴(Gemigliptin)으로 혈당조절이 불충분한 제 2형 당뇨병 환자를 대상으로 임상허가를 받았다.
‘DW1521’은 급성 또는 만성 위염 환자를 대상으로 유효성 및 안정성 평가를 진행 중이다.
한편, 주성분으로만 보면 소염진통제 ‘세레콕시브’, 고지혈증치료제 ‘아토르바스타틴’, 소염진통제 ‘펠루비프로펜’, 면역항암제 ‘펨브롤리주맙’(제품명 키트루다)의 임상시험 건수가 각각 9건으로 가장 많은 것으로 집계됐다. 이어 면역항암제 ‘티라골루맙’(8건), 아스트라제네카 항암 신약 DS-8201A(7건), 골관절염치료제 ‘아세클로페낙’(6건) 순이었다.
이외에도 당뇨병치료제 ‘DWP16001’, 면역항암제 ‘MEDI4736’, 고지혈증치료제 ‘로수바스타틴’, 경구용 항응고제 ‘리바록시반’, 위장운동조절제 ‘모사프리드시트르산’, 경구용 항응고제 ‘아픽사반’, 위식도역류질환제 ‘테고프라잔’, 항진균제 ‘플루코나졸’이 5건을 기록했다.

