의료법학회서 임상시험 대상자 동의에 대한 규정 불명확 등 문제점 지적
임상시험제도관련 중요사항의 법률화,구체화 촉구
[의학신문·일간보사=이재원 기자]의약품 임상시험이 최근 증가 추세에 있음에도 불구하고, 현행 약사법 등이 체계적으로 마련되어 있지 않아 임상시험의 안정성을 해친다는 주장이 법학전문가로부터 제기됐다.
특히 임상시험 대상자의 동의, 보상에 대한 규정의 불명확함이 문제로 지적되면서, 관련 법률의 체계화 및 구체화에 대한 필요가 강조되고 있다.
대한의료법학회는 20일 연세대학교 광복관에서 '대한의료법학회 학술회'를 개최했다.
이날 발표를 맡은 이세정 한국법제연구원 선임연구원은 국내 의약품 임상시험 제도의 문제점과 법 제도 개선의 필요성을 전했다.

발표에 따르면, 전체 의약품 임상시험 승인 건수는 2017년 658건에서 2018년 679건으로 21건(3.2%) 증가했다. 의약품 임상시험 승인 제도 도입(2002년) 이후 2003년 143건에 불과하던 임상시험 승인 건수는 약 4.7배 증가했으며, 2016년 628건에서 2017년 658건으로 30건(4.8%) 증가한 것에 이어 최근 3년간 의약품 임상시험 승인건수의 증가세 지속 중에 있다.
이처럼 증가 추세인 임상시험은 건강한 사람 또는 환자를 대상으로 하는 것으로 이들에게 건강상의 피해 등 불이익을 가져다 줄 수 있다. 또한 개발단계 및 시판인가, 시판 후 제품에 결함이 발견되는 경우, 인권의 침해, 건강상 피해, 약제 및 그 연구개발에 대한 불신과 불안을 야기하는 등 사회적·경제적 영향이 매우 크다.
때문에 임상시험제도의 효과적 운영을 통해 양질의 고부가가치 의약품을 개발할 필요가 있으며, 임상시험제도의 안정적 운영을 통해 국민의 생명 및 신체 등에 대한 위해 발생을 방지해야 한다.
그러나 현행 약사법령상 임상시험 관련 규정이 체계적으로 마련되어 있지 않는 등의 문제가 존재한다고 이세정 선임연구원은 밝혔다.
이세정 선임연구원은 "법률적 근거가 없거나 불명확하거나 애매모호한 규정이 많아 임상시험 관련 이해관계자의 법적 안정성과 예측가능성 등을 저해하고, 의약품 개발의 활성화에 장애가 된다"며 "임상시험제도 관련 개선이 시급하다"고 말했다.
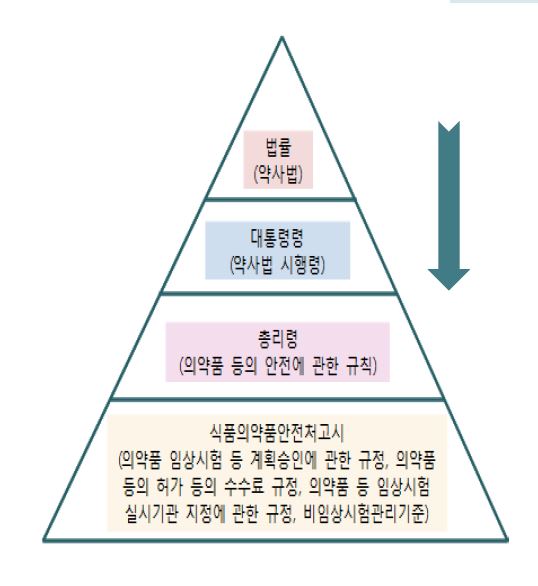
현행 법률인 약사법에서는 임상시험의 정의, 임상시험의 계획 승인 및 실시에 관한 기본적인 사항 등을 규정하고 있다. 과태료 부과기준은 약사법 시행령 대통령령에서, 제재적 행정처분기준은 의약품 등의 안전에 관한 규칙에서 규정한다.
또한 임상시험의 계획 승인 및 실시 등에 관한 보다 구체적인 사항은 '의약품 등의 안전에 관한 규칙'과 식품의약품안전처 고시인 '의약품 임상시험 등 계획 승인에 관한 규정' 등에서 정하며, 임상시험심사위원회제도에 관한 사항은 ‘임상시험의 관리기준’(Good Clinical Practice: GCP)에서 규정한다.
이세정 선임연구원에 따르면, 먼저 GCP상 ‘임상시험심사위원회’(Institutional Review Board: IRB)의 경우 임상시험의 실시, 일시중지, 종료(조기종료) 등에 이르기까지 임상시험 전반에 걸쳐 상당한 영향을 미치는 기구인데도 불구하고, 임상시험심사위원회 결정 위반행위에 대한 제재 등을 다루는 법률적 근거 부재한 것으로 나타났다.
이세정 연구원은 "이는 임상시험 의뢰자 책임자 등의 법적 안정성 예측가능성을 저해하고 임상시험심사위원회제도의 원활한 운영을 막는다"고 밝혔다.
또한 약사법상 임상시험 대상자의 동의와 보상에 대한 규정이 불명확한 것으로 나타났다.
임상시험은 사람을 대상으로 하는 것으로 시험대상자에게 건강상의 피해 등 불이익을 가져다 줄 수 있고, 이러한 사항을 시험대상자가 충분한 설명을 듣고 이에 동의한 뒤 임상시험에 임할 수 있도록 해야 한다. 또한 피해 발생 시 보상내용·기준, 방법, 절차 등이 사전에 명확하게 정해지고, 합리적이며 타당한 것이어야 한다.
그럼에도 불구하고 임상시험 대상자의 동의, 보상 등에 관한 사항이 현행 약사법에는 명확하게 규정되어 있지 않다. 현행 약사법은 임상시험을 하려는 자(의뢰자)에게는 약사법 제34조 제3항 제3호 및 제5호에 따라 임상시험 대상자에게 발생할 수 있는 건강상의 피해 발생으로 보상하는 경우에 임상시험 대상자에게 사전에 설명한 보상 절차 등을 준수할 것 정도만을 규정하고 있다.
이세정 연구원은 "약사법에서는 시험대상자에게 건강상의 피해 정도, 보상 내용 및 보상 신청 절차 등에 관하여 설명하고 동의를 받을 의무를 ‘임상시험실시기관’에 부여하고 있으나(약사법 제34조의2 제3항 제2호), 그 상세한 규정을 하위법령이나 행정규칙으로 정하도록 직접적으로 위임하고 있지 않다"고 전했다.
이외에도 △임상시험 대상자 동의,보상 규정 부정합 △임상시험 대상자에 대한 보상·기준, 보상 절차의 불충분 및 통일성 부재 △임상시험 대상자 동의 취득의 예외에 대한 법률적 근거 부재 △임상시험 관련 피규제자 용어의 혼용 불일치 등이 함께 문제로 지적됐다.
이 같이 빈약한 약사법 임상시험 관련 내용의 보완을 위해 이세정 연구원은 임상시험 관련 법령 체계 및 내용의 전면적 개편을 주장했다.
이세정 연구원은 법률과 하위법령 및 고시 등 행정규칙 간 체계적 정합성을 확보할 것을 먼저 주문했다.
이 연구원은 "법률에서 임상시험제도와 관련한 중요사항 직접 규정하고, 구체적이고 상세한 사항의 하위법령과 고시에서의 규정을 위한 상위법령상 위임 근거를 마련해야 한다"고 말했다.
이어 임상시험제도와 관련된 중요사항의 법률화 및 구체화가 필요하다는 견해도 함께 전했다.
이세정 연구원은 "동의 내용·방법 및 예외, 보상 내용·기준, 방법 및 절차 등을 법률화 및 구체화하고, IRB의 기능, 위상 및 중요성 등에 맞는 규범적 근거를 마련해야 한다"며 "연구자 임상시험제도의 촉진 및 원활한 운영을 위한 근거도 함께 마련해야 한다"고 말했다.

